Śląscy laureaci Nagrody Nobla w dziedzinie chemii: Różnice pomiędzy wersjami
Praktykant (dyskusja | edycje) |
Praktykant (dyskusja | edycje) Nie podano opisu zmian |
||
| (Nie pokazano 3 pośrednich wersji utworzonych przez tego samego użytkownika) | |||
| Linia 1: | Linia 1: | ||
[[Kategoria:Historia]] | |||
[[Kategoria:Indeks haseł – alfabetyczny]] | |||
[[Kategoria:Tom 7 (2020)]] | |||
Autor: [[ dr Aleksandra Garbacz]] | Autor: [[ dr Aleksandra Garbacz]] | ||
::::::::::::::::::::::::: ENCYKLOPEDIA WOJEWÓDZTWA ŚLĄSKIEGO | |||
:::::::::::::::::::::::::[[ENCYKLOPEDIA WOJEWÓDZTWA ŚLĄSKIEGO Tom 7 (2020)|TOM: 7 (2020)]] | |||
Pierwsze nagrody Nobla rozdano w 1901 roku. Inicjatorem, a zarazem fundatorem tego prestiżowego wyróżnienia był Alfred Bernhard Nobel (1833-1896). Chemik wynalazł, a następnie opatentował dynamit i balistyt, dzięki czemu wzbogacił się na produkcji materiałów wybuchowych. Prawdopodobnie poczucie winy spowodowało, iż zaczął się zastanawiać, w jaki sposób mógłby podzielić się swoim majątkiem z ludźmi zasłużonymi dla nauki. Zadecydował, że po śmierci jego majątek zostanie ulokowany w formie papierów wartościowych i będzie generował odsetki w postaci kapitału. Powstały w ten sposób fundusz ma stanowić nagrodę pieniężną dla pięciu osób, które w roku poprzednim do bieżącego, dokonały znaczących dla świata odkryć z dziedziny chemii, fizyki, fizjologii i medycyny, literatury oraz spraw związanych z pokojem na świecie. Coroczna pula odsetek miała zostać podzielona na pięć równych części i przyznana w formie nagrody pieniężnej za szczególne i wybitne osiągnięcia naukowe<ref> P. Greiner, „Nobliści z Górnego Śląska”, wyd. „Rzeka”, Wrocław 1999, str. 13-18; P. Greiner, „Nobliści śląscy”, wyd. „Wokół nas”, Gliwice 1999, str. 8-13</ref>. Wśród laureatów Nagrody Nobla znaleźli się także chemicy związani ze Śląskiem. | |||
==Kurt Alder== | |||
Kurt Alder urodził się 10 lipca 1902 roku w Königshütte (obecnie [[Chorzów]]). Dzieciństwo i młodość spędził w rodzinnym mieście, gdzie również rozpoczął naukę. W 1922 roku zdał egzamin maturalny i zaraz po tym przeniósł się z rodzicami do Berlina, a później do Kilonii. Studia chemiczne rozpoczął na Uniwersytecie Berlińskim, jednak jeszcze w tym samym roku przeniósł się na Uniwersytet Christiana Albrechta w Kilonii. Tam też poznał ówczesnego dyrektora Instytutu Chemii, Otto Dielsa. W 1926 roku Alder obronił pracę doktorską. Odrzucił propozycję objęcia stanowiska uczelnianego asystenta naukowo-dydaktycznego, aby w pełni skupić się na własnych badaniach laboratoryjnych. Podjął pracę jako nieetatowy asystent naukowo-badawczy, utrzymując się ze stypendiów naukowych oraz projektów badawczych. Od 1927 roku, wraz z Otto Dielsem, rozpoczął badania nad reakcjami pericyklicznymi z udziałem węglowodorów nienasyconych, takich jak alkeny i skwaleny. Pierwsza publikacja dotycząca nowoodkrytego mechanizmu reakcji nazwanej syntezą dienową ukazała się w 1928 roku. Od tego momentu kariera naukowa nikomu dotychczas nieznanego Kurta Aldera nabrała rozpędu. W styczniu 1930 roku uzyskał tytuł doktora habilitowanego, a we wrześniu 1934 roku został profesorem nadzwyczajnym. Przez wszystkie lata pracy i badań prowadzonych na uczelni, nie był zatrudniony jako pracownik etatowy. Całą uwagę skupiał tylko i wyłącznie na eksperymentach naukowych. Nagrodę Nobla w dziedzinie chemii „za odkrycie i rozwój syntezy dienowej” wraz z Otto Dielsem otrzymał w 1950 roku<ref> P. Greiner, „Nobliści z Górnego Śląska”, wyd. „Rzeka”, Wrocław 1999, str. 59-83; P. Greiner, „Nobliści śląscy”, wyd. „Wokół nas”, Gliwice 1999, str. 63-70.</ref>. Dziś synteza dienowa reprezentuje całą grupę reakcji zwanych reakcjami cykloaddycji | Kurt Alder urodził się 10 lipca 1902 roku w Königshütte (obecnie [[Chorzów]]). Dzieciństwo i młodość spędził w rodzinnym mieście, gdzie również rozpoczął naukę. W 1922 roku zdał egzamin maturalny i zaraz po tym przeniósł się z rodzicami do Berlina, a później do Kilonii. Studia chemiczne rozpoczął na Uniwersytecie Berlińskim, jednak jeszcze w tym samym roku przeniósł się na Uniwersytet Christiana Albrechta w Kilonii. Tam też poznał ówczesnego dyrektora Instytutu Chemii, Otto Dielsa. W 1926 roku Alder obronił pracę doktorską. Odrzucił propozycję objęcia stanowiska uczelnianego asystenta naukowo-dydaktycznego, aby w pełni skupić się na własnych badaniach laboratoryjnych. Podjął pracę jako nieetatowy asystent naukowo-badawczy, utrzymując się ze stypendiów naukowych oraz projektów badawczych. Od 1927 roku, wraz z Otto Dielsem, rozpoczął badania nad reakcjami pericyklicznymi z udziałem węglowodorów nienasyconych, takich jak alkeny i skwaleny. Pierwsza publikacja dotycząca nowoodkrytego mechanizmu reakcji nazwanej syntezą dienową ukazała się w 1928 roku. Od tego momentu kariera naukowa nikomu dotychczas nieznanego Kurta Aldera nabrała rozpędu. W styczniu 1930 roku uzyskał tytuł doktora habilitowanego, a we wrześniu 1934 roku został profesorem nadzwyczajnym. Przez wszystkie lata pracy i badań prowadzonych na uczelni, nie był zatrudniony jako pracownik etatowy. Całą uwagę skupiał tylko i wyłącznie na eksperymentach naukowych. Nagrodę Nobla w dziedzinie chemii „za odkrycie i rozwój syntezy dienowej” wraz z Otto Dielsem otrzymał w 1950 roku<ref> P. Greiner, „Nobliści z Górnego Śląska”, wyd. „Rzeka”, Wrocław 1999, str. 59-83; P. Greiner, „Nobliści śląscy”, wyd. „Wokół nas”, Gliwice 1999, str. 63-70.</ref>. Dziś synteza dienowa reprezentuje całą grupę reakcji zwanych reakcjami cykloaddycji | ||
| Linia 25: | Linia 29: | ||
Obecnie znanych jest już wiele możliwości kombinacji pomiędzy substratami w reakcjach cykloaddycji, dlatego przedstawiono tylko wybrane i najbardziej charakterystyczne przykłady. Związki chemiczne biorące udział w reakcjach cykloaddycji muszą mieć charakter nienasycony (obecne wiązania wielokrotne) lub dysponować wolną parą elektronową. Reakcja cykloaddycji jest reakcją perickliczną, co oznacza, że w trakcie jej przebiegu wszystkie wiązania tworzą się równocześnie, a w stanie przejściowym powstaje produkt o budowie cyklicznej. | Obecnie znanych jest już wiele możliwości kombinacji pomiędzy substratami w reakcjach cykloaddycji, dlatego przedstawiono tylko wybrane i najbardziej charakterystyczne przykłady. Związki chemiczne biorące udział w reakcjach cykloaddycji muszą mieć charakter nienasycony (obecne wiązania wielokrotne) lub dysponować wolną parą elektronową. Reakcja cykloaddycji jest reakcją perickliczną, co oznacza, że w trakcie jej przebiegu wszystkie wiązania tworzą się równocześnie, a w stanie przejściowym powstaje produkt o budowie cyklicznej. | ||
===Reakcja Dielsa-Aldera=== | |||
Jest to reakcja przebiegająca pomiędzy sprzężonym dienem, a dienofilem posiadającym przynajmniej jedno wiązanie wielokrotne. Pomiędzy substratami tworzą się nowe, mocne wiązania typu &sigma, kosztem zerwania wiązań typu &pi. Powstaje sześcioczłonowy cykliczny produkt. Rozpad starych i tworzenie nowych wiązań zachodzi równocześnie. Rysunek poniżej przedstawia proces tworzenia się nowych wiązań typu σ i zrywania wiązań typu &pi. | Jest to reakcja przebiegająca pomiędzy sprzężonym dienem, a dienofilem posiadającym przynajmniej jedno wiązanie wielokrotne. Pomiędzy substratami tworzą się nowe, mocne wiązania typu &sigma, kosztem zerwania wiązań typu &pi. Powstaje sześcioczłonowy cykliczny produkt. Rozpad starych i tworzenie nowych wiązań zachodzi równocześnie. Rysunek poniżej przedstawia proces tworzenia się nowych wiązań typu σ i zrywania wiązań typu &pi. | ||
| Linia 36: | Linia 40: | ||
[[Plik:nobel9.jpg|center|thumb|300px]] | [[Plik:nobel9.jpg|center|thumb|300px]] | ||
==Fritz Haber== | |||
Fritz Haber urodził się 9 grudnia 1868 roku we Wrocławiu. Po zdaniu egzaminu maturalnego w 1886 roku rozpoczął studia chemiczne. Jego macierzystą uczelnią był Uniwersytet Berliński, ale zajęcia kierunkowe odbywał także w Heildelbergu i Zurychu. W 1891 roku uzyskał tytuł doktora nauk chemicznych ze specjalnością chemia organiczna. Po ukończeniu studiów rozpoczął pracę w fabryce nawozów sztucznych niedaleko [[Mysłowice|Mysłowic]], by następnie przenieść się do fabryki Ludwika Knorra w Jenie. Równocześnie rozwijał się jako naukowiec, wydając we współpracy z Knorrem swój pierwszy artykuł, który dotyczył struktury węglowodanów. Po trzech latach pracy w branży przemysłowej Fritz Haber zatęsknił za środowiskiem akademickim i eksperymentem naukowym. W 1894 roku dostał pracę na Politechnice w Karlsruhe w Badenii, gdzie objął stanowisko asystenta w Instytucie Chemii Paliw Hansa Buntego. Prowadził w tym czasie badania z zakresu elektrochemii i katalizy, a dwa lata później jako doktor habilitowany objął tam stanowisko wykładowcy. Podsumowaniem jego badań było napisanie podręcznika do elektrochemii, w którym przedstawił tzw. schemat Habera. Wydanie książki przyniosło mu awans na stanowisko profesora nadzwyczajnego chemii technicznej. Od 1904 roku pracował nad równowagą reakcji syntezy amoniaku z atomów azotu i wodoru w warunkach wysokich temperatur i pod działaniem wysokiego ciśnienia. W 1905 roku ukazał się kolejny podręcznik Habera, który dotyczył termodynamiki gazów technicznych, a rok później został profesorem zwyczajnym chemii fizycznej i dyrektorem Instytutu Chemii Paliw<ref> P. Greiner, „Nobliści śląscy”, wyd. „Wokół nas”, Gliwice 1999, str. 38-45.</ref>. | Fritz Haber urodził się 9 grudnia 1868 roku we Wrocławiu. Po zdaniu egzaminu maturalnego w 1886 roku rozpoczął studia chemiczne. Jego macierzystą uczelnią był Uniwersytet Berliński, ale zajęcia kierunkowe odbywał także w Heildelbergu i Zurychu. W 1891 roku uzyskał tytuł doktora nauk chemicznych ze specjalnością chemia organiczna. Po ukończeniu studiów rozpoczął pracę w fabryce nawozów sztucznych niedaleko [[Mysłowice|Mysłowic]], by następnie przenieść się do fabryki Ludwika Knorra w Jenie. Równocześnie rozwijał się jako naukowiec, wydając we współpracy z Knorrem swój pierwszy artykuł, który dotyczył struktury węglowodanów. Po trzech latach pracy w branży przemysłowej Fritz Haber zatęsknił za środowiskiem akademickim i eksperymentem naukowym. W 1894 roku dostał pracę na Politechnice w Karlsruhe w Badenii, gdzie objął stanowisko asystenta w Instytucie Chemii Paliw Hansa Buntego. Prowadził w tym czasie badania z zakresu elektrochemii i katalizy, a dwa lata później jako doktor habilitowany objął tam stanowisko wykładowcy. Podsumowaniem jego badań było napisanie podręcznika do elektrochemii, w którym przedstawił tzw. schemat Habera. Wydanie książki przyniosło mu awans na stanowisko profesora nadzwyczajnego chemii technicznej. Od 1904 roku pracował nad równowagą reakcji syntezy amoniaku z atomów azotu i wodoru w warunkach wysokich temperatur i pod działaniem wysokiego ciśnienia. W 1905 roku ukazał się kolejny podręcznik Habera, który dotyczył termodynamiki gazów technicznych, a rok później został profesorem zwyczajnym chemii fizycznej i dyrektorem Instytutu Chemii Paliw<ref> P. Greiner, „Nobliści śląscy”, wyd. „Wokół nas”, Gliwice 1999, str. 38-45.</ref>. | ||
| Linia 50: | Linia 54: | ||
Warunki obniżonej temperatury i wysokiego ciśnienia sprzyjają powstawaniu zwiększonej ilości ciekłego amoniaku w mieszaninie poreakcyjnej i przesuwają równowagę reakcji w kierunku syntezy amoniaku. Jednocześnie obniżanie temperatury prowadzi do spadku szybkości reakcji, nawet przy wykorzystaniu bardzo dobrego katalizatora. Dlatego niezbędne jest znalezienie optymalnego przedziału temperatur i ciśnień, przy których uzyskuje się akceptowalną szybkość tworzenia amoniaku oraz wydajność tej reakcji. W praktyce przemysłowej reakcja ta jest przeprowadzana w warunkach ciśnienia od 30 do 35 MPa oraz temperatur wahających się pomiędzy 770 a 820 K. Azot do produkcji amoniaku może być pozyskiwany z powietrza lub z gazu generatorowego, który jest otrzymywany na drodze procesu przepuszczania strumienia powietrza przez rozżarzony koks. Źródłem wodoru natomiast jest gaz ziemny i ropa naftowa. | Warunki obniżonej temperatury i wysokiego ciśnienia sprzyjają powstawaniu zwiększonej ilości ciekłego amoniaku w mieszaninie poreakcyjnej i przesuwają równowagę reakcji w kierunku syntezy amoniaku. Jednocześnie obniżanie temperatury prowadzi do spadku szybkości reakcji, nawet przy wykorzystaniu bardzo dobrego katalizatora. Dlatego niezbędne jest znalezienie optymalnego przedziału temperatur i ciśnień, przy których uzyskuje się akceptowalną szybkość tworzenia amoniaku oraz wydajność tej reakcji. W praktyce przemysłowej reakcja ta jest przeprowadzana w warunkach ciśnienia od 30 do 35 MPa oraz temperatur wahających się pomiędzy 770 a 820 K. Azot do produkcji amoniaku może być pozyskiwany z powietrza lub z gazu generatorowego, który jest otrzymywany na drodze procesu przepuszczania strumienia powietrza przez rozżarzony koks. Źródłem wodoru natomiast jest gaz ziemny i ropa naftowa. | ||
===Amoniak-własności i jego rola w chemii i w przemyśle=== | |||
Cząsteczka amoniaku ma budowę piramidalną, co przedstawiono na rysunku poniżej. Wolna, niewiążąca para elektronowa znajdująca się na shybrydyzowanym orbitalu sp3 powoduje „efekt spychania” wiązań typu N-H. W związku z tym, kąt N-H-N jest równy 106˚ 45’, a nie 109˚ 28’, jak byłoby w przypadku występowania czterech równocennych wiązań przy atomie shybrydyzowanym tetraedrycznie<ref>A. Bielański, Podstawy chemii nieorganicznej, część 2, wyd. naukowe PWN, Warszawa 1994, str. 644-646</ref>. | Cząsteczka amoniaku ma budowę piramidalną, co przedstawiono na rysunku poniżej. Wolna, niewiążąca para elektronowa znajdująca się na shybrydyzowanym orbitalu sp3 powoduje „efekt spychania” wiązań typu N-H. W związku z tym, kąt N-H-N jest równy 106˚ 45’, a nie 109˚ 28’, jak byłoby w przypadku występowania czterech równocennych wiązań przy atomie shybrydyzowanym tetraedrycznie<ref>A. Bielański, Podstawy chemii nieorganicznej, część 2, wyd. naukowe PWN, Warszawa 1994, str. 644-646</ref>. | ||
| Linia 100: | Linia 104: | ||
Ze względu na ogólną szkodliwość i drażniący wpływ na błony śluzowe, amoniak został prawie całkowicie wycofywany z przemysłu chemicznego zajmującego się produkcją lakierów, farb i środków czyszczących, które mają bezpośredni kontakt ze skórą i drogami oddechowymi. | Ze względu na ogólną szkodliwość i drażniący wpływ na błony śluzowe, amoniak został prawie całkowicie wycofywany z przemysłu chemicznego zajmującego się produkcją lakierów, farb i środków czyszczących, które mają bezpośredni kontakt ze skórą i drogami oddechowymi. | ||
==Friedrich Bergius== | |||
Friedrich Bergius urodził się 11 października 1884 roku w Złotnikach (obecnie dzielnica Wrocławia). Miejskie gimnazjum realne we Wrocławiu ukończył zdając egzamin dojrzałości w 1903 roku. Chemia była jego pasją już od czasów szkoły średniej. Pierwsze praktyki pobierał w laboratorium w fabryce swojego ojca. Przed rozpoczęciem studiów chemicznych na Uniwersytecie we Wrocławiu, odbył półroczną praktykę w zakładach hutniczych w Zagłębiu Ruhry. Pracę doktorską z zakresu chemii nieorganicznej obronił na Uniwersytecie w Lipsku w 1907 roku, gdzie przeniósł się rok wcześniej. Tematem jego dysertacji był problem bezwodnego kwasu siarkowego jako rozpuszczalnika. Jeszcze w tym samym roku objął stanowisko asystenta w Instytucie Chemii Fizycznej na Uniwersytecie w Berlinie. Następnie po dwóch semestrach podjął pracę w Instytucie Chemii Paliw na politechnice w Karlsruhe, gdzie miał okazję współpracować z Fritzem Haberem i brać udział w badaniach związanych z syntezą amoniaku. Od tej pory jego uwaga skupiała się na badaniach syntez w warunkach wysokotemperaturowych i pod wysokim ciśnieniem. W 1910 roku przeniósł się na politechnikę w Hanowerze, gdzie rozpoczął pracę w Instytucie Chemii Fizycznej. Po dwóch latach zrobił tam habilitację. W związku z tym, że na uczelni nie mógł realizować swoich planów badawczych, podjął decyzję o otwarciu własnego laboratorium. Zajął się szerzej zagadnieniem wyodrębniania benzyny z olejów ciężkich oraz uwodornieniem węgla w wysokich temperaturach i pod wysokim ciśnieniem. Pierwsze widoczne sukcesy prac Bergiusa przypadały na rok 1913, kiedy to zgłosił patent na proces uwodorowienia węgla na węglowodory naftopodobne. Aby jego odkrycie mogło zostać przyjęte w realnym procesie przemysłowym, oprócz odpowiednich warunków i aparatury badawczej niezbędne było zastosowanie odpowiedniego katalizatora. Umożliwiłoby to otrzymanie pożądanego produktu odpowiednio szybko i z dobrą wydajnością. W związku z brakiem funduszy na rozwój badań, Friedrich Bergius zdecydował się nawiązać współpracę ze swoim przyjacielem K. Goldschmidtem. Zainwestował w budowę linii technologicznej w Mannheim-Rheinau, gdzie miałby zajmować się uwodorowaniem węgla i osobiście nadzorować proces produkcyjny. Wybuch [[Pierwsza wojna światowa|I wojny światowej]] przekreślił na kilka lat jego plany. Cztery lata po zakończeniu wojny wznowiono proces produkcji benzyny i związków naftopodobnych. Jednak w dalszym ciągu produkcja benzyny nie była opłacalna z ekonomicznego punktu widzenia. Całe przedsięwzięcie zrujnowało Bergiusa finansowo. Pomimo znalezienia odpowiedniego katalizatora w postaci siarczku molibdenu, był zmuszony sprzedać swoje patenty firmie Badische Anilin- und Soda-Fabrik. BASF udało się rozwinąć produkcję benzyny w zakładach uwodorowania węgla na skalę przemysłową, co okazało się niezwykle korzystne dla Niemiec w czasie [[Druga wojna światowa|II wojny światowej]]. Oprócz badań związanych z uwodorowaniem węgla Bergius pracował również nad hydrolizą celulozy drzewnej w celu otrzymania glukozy. Jednak w związku z brakiem wystarczających środków finansowych i ograniczeniami technologicznymi, pomimo kilku prób powrotu do badań, zakończyły się one fiaskiem. Osiągnięcia Friedricha Bergiusa dla nauki i przemysłu były jednak tak ważne, że został doceniony i odznaczony Nagrodą Nobla w dziedzinie chemii w 1931 roku. Nagrodę otrzymał wspólnie z Carlem Boschem „za badania wpływu wysokich ciśnień na przebieg reakcji chemicznych”<ref> P. Greiner, „Nobliści śląscy”, wyd. „Wokół nas”, Gliwice 1999, str. 46-50 </ref>. | Friedrich Bergius urodził się 11 października 1884 roku w Złotnikach (obecnie dzielnica Wrocławia). Miejskie gimnazjum realne we Wrocławiu ukończył zdając egzamin dojrzałości w 1903 roku. Chemia była jego pasją już od czasów szkoły średniej. Pierwsze praktyki pobierał w laboratorium w fabryce swojego ojca. Przed rozpoczęciem studiów chemicznych na Uniwersytecie we Wrocławiu, odbył półroczną praktykę w zakładach hutniczych w Zagłębiu Ruhry. Pracę doktorską z zakresu chemii nieorganicznej obronił na Uniwersytecie w Lipsku w 1907 roku, gdzie przeniósł się rok wcześniej. Tematem jego dysertacji był problem bezwodnego kwasu siarkowego jako rozpuszczalnika. Jeszcze w tym samym roku objął stanowisko asystenta w Instytucie Chemii Fizycznej na Uniwersytecie w Berlinie. Następnie po dwóch semestrach podjął pracę w Instytucie Chemii Paliw na politechnice w Karlsruhe, gdzie miał okazję współpracować z Fritzem Haberem i brać udział w badaniach związanych z syntezą amoniaku. Od tej pory jego uwaga skupiała się na badaniach syntez w warunkach wysokotemperaturowych i pod wysokim ciśnieniem. W 1910 roku przeniósł się na politechnikę w Hanowerze, gdzie rozpoczął pracę w Instytucie Chemii Fizycznej. Po dwóch latach zrobił tam habilitację. W związku z tym, że na uczelni nie mógł realizować swoich planów badawczych, podjął decyzję o otwarciu własnego laboratorium. Zajął się szerzej zagadnieniem wyodrębniania benzyny z olejów ciężkich oraz uwodornieniem węgla w wysokich temperaturach i pod wysokim ciśnieniem. Pierwsze widoczne sukcesy prac Bergiusa przypadały na rok 1913, kiedy to zgłosił patent na proces uwodorowienia węgla na węglowodory naftopodobne. Aby jego odkrycie mogło zostać przyjęte w realnym procesie przemysłowym, oprócz odpowiednich warunków i aparatury badawczej niezbędne było zastosowanie odpowiedniego katalizatora. Umożliwiłoby to otrzymanie pożądanego produktu odpowiednio szybko i z dobrą wydajnością. W związku z brakiem funduszy na rozwój badań, Friedrich Bergius zdecydował się nawiązać współpracę ze swoim przyjacielem K. Goldschmidtem. Zainwestował w budowę linii technologicznej w Mannheim-Rheinau, gdzie miałby zajmować się uwodorowaniem węgla i osobiście nadzorować proces produkcyjny. Wybuch [[Pierwsza wojna światowa|I wojny światowej]] przekreślił na kilka lat jego plany. Cztery lata po zakończeniu wojny wznowiono proces produkcji benzyny i związków naftopodobnych. Jednak w dalszym ciągu produkcja benzyny nie była opłacalna z ekonomicznego punktu widzenia. Całe przedsięwzięcie zrujnowało Bergiusa finansowo. Pomimo znalezienia odpowiedniego katalizatora w postaci siarczku molibdenu, był zmuszony sprzedać swoje patenty firmie Badische Anilin- und Soda-Fabrik. BASF udało się rozwinąć produkcję benzyny w zakładach uwodorowania węgla na skalę przemysłową, co okazało się niezwykle korzystne dla Niemiec w czasie [[Druga wojna światowa|II wojny światowej]]. Oprócz badań związanych z uwodorowaniem węgla Bergius pracował również nad hydrolizą celulozy drzewnej w celu otrzymania glukozy. Jednak w związku z brakiem wystarczających środków finansowych i ograniczeniami technologicznymi, pomimo kilku prób powrotu do badań, zakończyły się one fiaskiem. Osiągnięcia Friedricha Bergiusa dla nauki i przemysłu były jednak tak ważne, że został doceniony i odznaczony Nagrodą Nobla w dziedzinie chemii w 1931 roku. Nagrodę otrzymał wspólnie z Carlem Boschem „za badania wpływu wysokich ciśnień na przebieg reakcji chemicznych”<ref> P. Greiner, „Nobliści śląscy”, wyd. „Wokół nas”, Gliwice 1999, str. 46-50 </ref>. | ||
==Metody przeróbki węgla do paliw płynnych== | ===Metody przeróbki węgla do paliw płynnych=== | ||
<ref>J. Świądrowski, A. Rejman-Burzyńska, E. Jędrysik, Węgiel brunatny jako surowiec do produkcji paliw płynnych, Górnictwo i Geoinżynieria, Rok 31, zeszyt 2, 2007, str. 595-596.</ref> | <ref>J. Świądrowski, A. Rejman-Burzyńska, E. Jędrysik, Węgiel brunatny jako surowiec do produkcji paliw płynnych, Górnictwo i Geoinżynieria, Rok 31, zeszyt 2, 2007, str. 595-596.</ref> | ||
Aktualna wersja na dzień 12:14, 28 lip 2020
Autor: dr Aleksandra Garbacz
- ENCYKLOPEDIA WOJEWÓDZTWA ŚLĄSKIEGO
- TOM: 7 (2020)
Pierwsze nagrody Nobla rozdano w 1901 roku. Inicjatorem, a zarazem fundatorem tego prestiżowego wyróżnienia był Alfred Bernhard Nobel (1833-1896). Chemik wynalazł, a następnie opatentował dynamit i balistyt, dzięki czemu wzbogacił się na produkcji materiałów wybuchowych. Prawdopodobnie poczucie winy spowodowało, iż zaczął się zastanawiać, w jaki sposób mógłby podzielić się swoim majątkiem z ludźmi zasłużonymi dla nauki. Zadecydował, że po śmierci jego majątek zostanie ulokowany w formie papierów wartościowych i będzie generował odsetki w postaci kapitału. Powstały w ten sposób fundusz ma stanowić nagrodę pieniężną dla pięciu osób, które w roku poprzednim do bieżącego, dokonały znaczących dla świata odkryć z dziedziny chemii, fizyki, fizjologii i medycyny, literatury oraz spraw związanych z pokojem na świecie. Coroczna pula odsetek miała zostać podzielona na pięć równych części i przyznana w formie nagrody pieniężnej za szczególne i wybitne osiągnięcia naukowe[1]. Wśród laureatów Nagrody Nobla znaleźli się także chemicy związani ze Śląskiem.
Kurt Alder
Kurt Alder urodził się 10 lipca 1902 roku w Königshütte (obecnie Chorzów). Dzieciństwo i młodość spędził w rodzinnym mieście, gdzie również rozpoczął naukę. W 1922 roku zdał egzamin maturalny i zaraz po tym przeniósł się z rodzicami do Berlina, a później do Kilonii. Studia chemiczne rozpoczął na Uniwersytecie Berlińskim, jednak jeszcze w tym samym roku przeniósł się na Uniwersytet Christiana Albrechta w Kilonii. Tam też poznał ówczesnego dyrektora Instytutu Chemii, Otto Dielsa. W 1926 roku Alder obronił pracę doktorską. Odrzucił propozycję objęcia stanowiska uczelnianego asystenta naukowo-dydaktycznego, aby w pełni skupić się na własnych badaniach laboratoryjnych. Podjął pracę jako nieetatowy asystent naukowo-badawczy, utrzymując się ze stypendiów naukowych oraz projektów badawczych. Od 1927 roku, wraz z Otto Dielsem, rozpoczął badania nad reakcjami pericyklicznymi z udziałem węglowodorów nienasyconych, takich jak alkeny i skwaleny. Pierwsza publikacja dotycząca nowoodkrytego mechanizmu reakcji nazwanej syntezą dienową ukazała się w 1928 roku. Od tego momentu kariera naukowa nikomu dotychczas nieznanego Kurta Aldera nabrała rozpędu. W styczniu 1930 roku uzyskał tytuł doktora habilitowanego, a we wrześniu 1934 roku został profesorem nadzwyczajnym. Przez wszystkie lata pracy i badań prowadzonych na uczelni, nie był zatrudniony jako pracownik etatowy. Całą uwagę skupiał tylko i wyłącznie na eksperymentach naukowych. Nagrodę Nobla w dziedzinie chemii „za odkrycie i rozwój syntezy dienowej” wraz z Otto Dielsem otrzymał w 1950 roku[2]. Dziś synteza dienowa reprezentuje całą grupę reakcji zwanych reakcjami cykloaddycji
Reakcja cykloaddycji
Reakcja cykloaddycji jest typem reakcji pericyklicznej, w wyniku której z substratów o budowie liniowej powstaje cykliczny produkt. Wśród reakcji cykloaddycji można wyróżnić:
- Reakcja cykloaddycji [4+2]
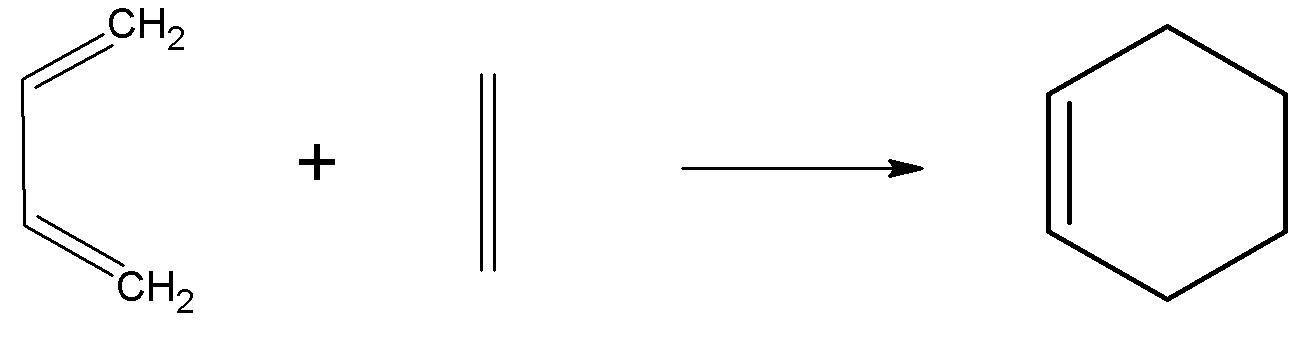
- Reakcja cykloaddycji [3+2]

- Reakcja cykloaddycji [2+2]
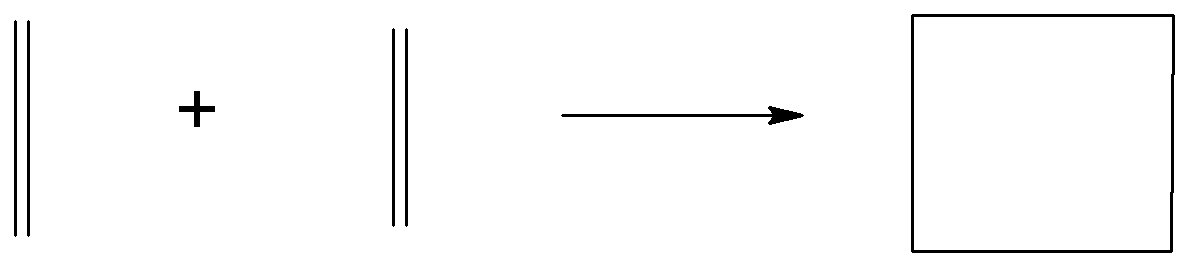
- Reakcja cykloaddycji [1+2]
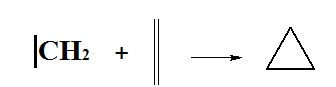
- Reakcja cykloaddycji [2+2+2]

Obecnie znanych jest już wiele możliwości kombinacji pomiędzy substratami w reakcjach cykloaddycji, dlatego przedstawiono tylko wybrane i najbardziej charakterystyczne przykłady. Związki chemiczne biorące udział w reakcjach cykloaddycji muszą mieć charakter nienasycony (obecne wiązania wielokrotne) lub dysponować wolną parą elektronową. Reakcja cykloaddycji jest reakcją perickliczną, co oznacza, że w trakcie jej przebiegu wszystkie wiązania tworzą się równocześnie, a w stanie przejściowym powstaje produkt o budowie cyklicznej.
Reakcja Dielsa-Aldera
Jest to reakcja przebiegająca pomiędzy sprzężonym dienem, a dienofilem posiadającym przynajmniej jedno wiązanie wielokrotne. Pomiędzy substratami tworzą się nowe, mocne wiązania typu &sigma, kosztem zerwania wiązań typu &pi. Powstaje sześcioczłonowy cykliczny produkt. Rozpad starych i tworzenie nowych wiązań zachodzi równocześnie. Rysunek poniżej przedstawia proces tworzenia się nowych wiązań typu σ i zrywania wiązań typu &pi.

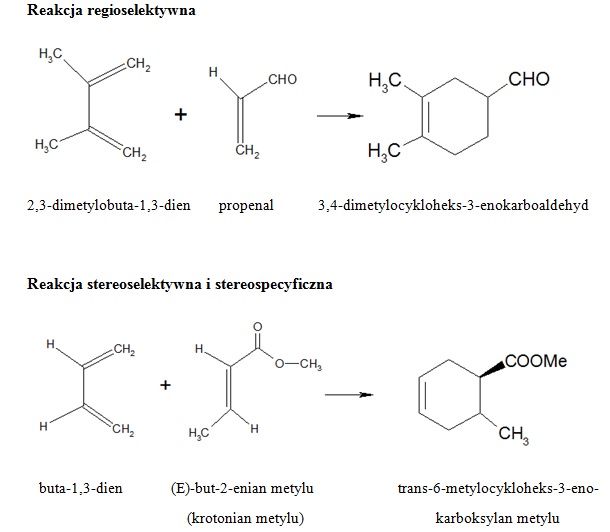
Odkrycie reakcji, a następnie poznanie jej mechanizmu było jednym z największych osiągnięć w dziedzinie syntezy organicznej. Stanowi ona doskonałe narzędzie do planowania i kontrolowania przebiegu reakcji w celu otrzymania pożądanego, ściśle określonego produktu. Bezwodnik tetrahydroftalowy, będący produktem reakcji Dielsa-Aldera, wykorzystywany jest jako półprodukt do produkcji poliestrów i specjalistycznych żywic, a także plastyfikatorów i środków klejących. Benzen jest substratem w reakcji syntezy aniliny i fenolu, a ponadto stosowany jest w produkcji leków, barwników, detergentów, pestycydów i tworzyw sztucznych. Produkt o określonej strukturze chemicznej i geometrycznej posiada również określone i charakterystyczne właściwości. Reakcja Dielsa-Aldera umożliwia otrzymanie cyklicznego produktu w jednym etapie, bezpośrednio, a uzyskany produkt z uwagi na obecność wiązań wielokrotnych typu węgiel-węgiel może ulegać dalszym przemianom chemicznym, czyli innymi słowy jest produktem pośrednim. Reakcja cykloaddycji jest reakcją regioselektywną, stereoselektywną i stereospecyficzną. Jak wynika z rysunku poniżej, substraty mogą reagować ze sobą nie tylko w stosunku 1:1, ale także 1:2, dając odpowiednio mono- i diaddukt.
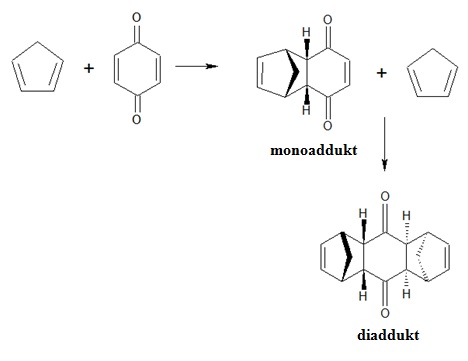
Regio- i stereospecyficzność reakcji polega na różnym położeniu grup funkcyjnych. Różnice dotyczą zarówno miejsca położenia podstawników względem siebie, to jest w położeniu orto, meta i para, jak i względem płaszczyzny cząsteczki (położenie cis i trans lub E i Z).

Stereoselektywność i stereospecyficzność reakcji dotyczą głównie preferowanej konfiguracji atomów w przestrzeni.
Fritz Haber
Fritz Haber urodził się 9 grudnia 1868 roku we Wrocławiu. Po zdaniu egzaminu maturalnego w 1886 roku rozpoczął studia chemiczne. Jego macierzystą uczelnią był Uniwersytet Berliński, ale zajęcia kierunkowe odbywał także w Heildelbergu i Zurychu. W 1891 roku uzyskał tytuł doktora nauk chemicznych ze specjalnością chemia organiczna. Po ukończeniu studiów rozpoczął pracę w fabryce nawozów sztucznych niedaleko Mysłowic, by następnie przenieść się do fabryki Ludwika Knorra w Jenie. Równocześnie rozwijał się jako naukowiec, wydając we współpracy z Knorrem swój pierwszy artykuł, który dotyczył struktury węglowodanów. Po trzech latach pracy w branży przemysłowej Fritz Haber zatęsknił za środowiskiem akademickim i eksperymentem naukowym. W 1894 roku dostał pracę na Politechnice w Karlsruhe w Badenii, gdzie objął stanowisko asystenta w Instytucie Chemii Paliw Hansa Buntego. Prowadził w tym czasie badania z zakresu elektrochemii i katalizy, a dwa lata później jako doktor habilitowany objął tam stanowisko wykładowcy. Podsumowaniem jego badań było napisanie podręcznika do elektrochemii, w którym przedstawił tzw. schemat Habera. Wydanie książki przyniosło mu awans na stanowisko profesora nadzwyczajnego chemii technicznej. Od 1904 roku pracował nad równowagą reakcji syntezy amoniaku z atomów azotu i wodoru w warunkach wysokich temperatur i pod działaniem wysokiego ciśnienia. W 1905 roku ukazał się kolejny podręcznik Habera, który dotyczył termodynamiki gazów technicznych, a rok później został profesorem zwyczajnym chemii fizycznej i dyrektorem Instytutu Chemii Paliw[3].
Synteza amoniaku
Prognozy klęski głodu w Europie jeszcze bardziej zmotywowały Habera do zintensyfikowania swoich badań. W przeprowadzanych eksperymentach wykorzystał spostrzeżenia Justusa von Liebiga, który zbadał i opisał bardzo korzystny wpływ związków azotu na wzrost roślin. Rozwój rolnictwa na początku XX wieku uzależniony był od importu saletry z Chile. W sytuacji realnego zagrożenia wyczerpaniem jej zasobów naturalnych, producenci rolni postanowili uniezależnić się od konieczności importu. Najlepszym rozwiązaniem okazała się rodzima produkcja azotowych nawozów sztucznych. W związku z tym zakłady Badische Anilin- und Sodafabrik (BASF) zaproponowały Haberowi współpracę. Było to następstwem opracowania przez niego w latach 1905–1910 metody syntezy amoniaku, nazwaną później metodą Habera i Boscha. W 1908 roku Fritz Haber otrzymał po raz pierwszy ciekły amoniak metodą półprzemysłową. Metoda syntezy amoniaku polegała na bezpośredniej reakcji pomiędzy atomami wodoru i azotu. Dzięki temu możliwe, a co najważniejsze z ekonomicznego punktu widzenia opłacalne, stało się produkowanie amoniaku na masową skalę, z wykorzystaniem katalizatorów i w warunkach wysokiej temperatury i wysokiego ciśnienia. Jednym z dwóch pionierskich zakładów przemysłowo produkujących amoniak tą metodą były Zakłady Azotowe w Chorzowie. Proces opatentowany przez Habera polegał na wpompowywaniu do reaktorów azotu i wodoru, które pod wpływem wysokiej temperatury i ciśnienia w obecności katalizatora łączyły się tworząc amoniak. W 1913 roku przedsiębiorstwo BASF wybudowało fabrykę w Oppau (obecnie Niemcy), w której rozpoczęto przygotowania do produkcji amoniaku. Produkcja masowa ruszyła dopiero dwa lata później, czyli po włączeniu do instalacji Habera specjalnego autoklawu zaprojektowanego przez Carla Boscha, w którym wodór o temperaturze 500˚C mógł być traktowany ciśnieniem rzędu 200 atmosfer. Opatentowanie metody syntezy amoniaku z pierwiastków znalazło również zastosowanie przy produkcji materiałów wybuchowych. To przełomowe odkrycie przyniosło Haberowi awans na stanowisko dyrektora Kaiser-Wilhelm Institut für physikalische Chemie und Elektrochemie oraz stanowisko profesora zwyczajnego na Uniwersytecie Berlińskim. Jako autorytet i specjalista w dziedzinie chemii gazów zaangażował się w opracowywanie gazów bojowych na potrzeby przemysłu zbrojeniowego Niemiec. Za jego wkład w produkcję śmiercionośnych gazów został uznany przez środowisko naukowe krajów Ententy za zbrodniarza wojennego. Pomijając względy etyczne związane z jego wynalazkiem, za nieoceniony wkład w rozwój nauki został doceniony przez Radę Dyrektorów Fundacji Noblowskiej i w roku 1919 uhonorowany Nagrodą Nobla za „opracowanie syntezy amoniaku z pierwiastków azotu i wodoru”. Fritz Haber był bardzo aktywnym działaczem na rzecz odbudowy przemysłu zbrojeniowego Niemiec, nadszarpniętego latami wojny. W latach dwudziestych XX wieku, współpracownicy Habera pod jego nadzorem opracowali technologię produkcji gazu zwanego cyklonem B. Pierwotne zastosowanie gazu miało służyć dezynfekcji i dezynsekcji, ale z czasem Niemcy zaczęli stosować go w komorach gazowych[4].

- Azot i wodór są umieszczane w sprężarce, gdzie osiągają ciśnienie kilkuset atmosfer
- Reakcja pomiędzy gazami jest katalizowana za pomocą metalicznego żelaza z dodatkiem tlenków wapnia, glinu i potasu jako promotorów
- Poreakcyjna mieszanina gazów jest następnie ochładzana w celu skroplenia i wyodrębnienia amoniaku. Nieprzereagowany azot i wodór pozostają w tych warunkach w fazie gazowej i z powrotem są kierowane na katalizator
Warunki obniżonej temperatury i wysokiego ciśnienia sprzyjają powstawaniu zwiększonej ilości ciekłego amoniaku w mieszaninie poreakcyjnej i przesuwają równowagę reakcji w kierunku syntezy amoniaku. Jednocześnie obniżanie temperatury prowadzi do spadku szybkości reakcji, nawet przy wykorzystaniu bardzo dobrego katalizatora. Dlatego niezbędne jest znalezienie optymalnego przedziału temperatur i ciśnień, przy których uzyskuje się akceptowalną szybkość tworzenia amoniaku oraz wydajność tej reakcji. W praktyce przemysłowej reakcja ta jest przeprowadzana w warunkach ciśnienia od 30 do 35 MPa oraz temperatur wahających się pomiędzy 770 a 820 K. Azot do produkcji amoniaku może być pozyskiwany z powietrza lub z gazu generatorowego, który jest otrzymywany na drodze procesu przepuszczania strumienia powietrza przez rozżarzony koks. Źródłem wodoru natomiast jest gaz ziemny i ropa naftowa.
Amoniak-własności i jego rola w chemii i w przemyśle
Cząsteczka amoniaku ma budowę piramidalną, co przedstawiono na rysunku poniżej. Wolna, niewiążąca para elektronowa znajdująca się na shybrydyzowanym orbitalu sp3 powoduje „efekt spychania” wiązań typu N-H. W związku z tym, kąt N-H-N jest równy 106˚ 45’, a nie 109˚ 28’, jak byłoby w przypadku występowania czterech równocennych wiązań przy atomie shybrydyzowanym tetraedrycznie[5].
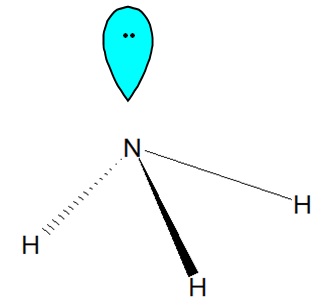
Cząsteczka amoniaku z zaznaczonymi wiązaniami N-H oraz wolną parą elektronową znajdującą się na orbitalu typu sp3 atomu azotu
W warunkach normalnych amoniak jest bezbarwnym gazem o ostrym i drażniącym zapachu. Tt= -78˚C, Tw= -33˚C
Ciekły amoniak ulega autodysocjacji według równania: NH3↔NH2- + NH4+. Jest bardzo dobrze rozpuszczalny w wodzie z uwagi na występowanie wiązań wodorowych, które tworzą się zarówno pomiędzy cząsteczkami amoniaku, jak i pomiędzy cząsteczkami wody i cząsteczkami amoniaku, co przedstawia rysunek poniżej. Wiązania wodorowe zaznaczono przerywaną linią.
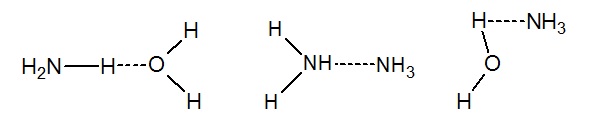
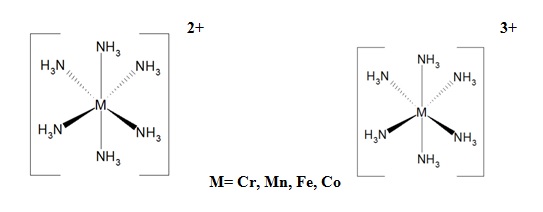
Wodny roztwór amoniaku ma charakter zasadowy, z uwagi na występowanie wolnej pary elektronowej. Na powietrzu spala się do azotu cząsteczkowego N2, a reakcja spalania jest silnie egzotermiczna. W związku z tym, aby otrzymać tlenek azotu (II), niezbędne jest użycie katalizatora Pt lub Pt/Rh, oraz temperatury z zakresu 750-900˚C. Reakcja przebiega z wydzieleniem dużej ilości ciepła. Amoniak syntetyczny jest głównie przetwarzany na kwas azotowy i sole amoniowe, a następnie zasila sektor rolnictwa w postaci nawozów sztucznych. Ponadto woda amoniakalna jest kierowana do laboratoriów. Alkiloaminy są wykorzystywane do produkcji leków i środków owadobójczych. Aminy i ich pochodne, kwas azotowy oraz sole amoniowe pełnią ważną rolę w syntezie organicznej. Aminy są także budulcem aminokwasów. Amoniak wykorzystywany jest również w chemii analitycznej i krystalografii, gdzie cząsteczka amoniaku pełni rolę liganda (aminakompleksy). Amoniak tworzy kompleksy z metalami przejściowymi typu [M(NH3)6]2+ i [M(NH3)6] 3+
Otrzymywanie katalizatora żelazowego
Syntetyczny Fe3O4 jest przetapiany z promotorami, takimi jak Al2O3 , CaO i K2O. Następnie w reaktorze tlenek żelaza ulega redukcji do żelaza metalicznego i dopiero wówczas staje się czynny katalitycznie[6].
Mechanizm reakcji syntezy amoniaku na katalizatorze żelazowym
- Katalizator żelazowy zaznaczony jako „Fe”
N2+2Fe-↔2Fe-N (ads.) H2+2Fe-↔2Fe-H (ads.) N(ads.)+ H(ads.) ↔NH(ads.) NH(ads.)+H(ads.) ↔NH2(ads.) NH2(ads.)+H(ads.) ↔ NH3(ads.) NH3(ads.) ↔ NH3(desorpcja)
- „Kat” jako centrum aktywne katalizatora żelazowego
N2(g)+ Kat = N2-Kat N2-Kat + Kat = 2N-Kat H2(g)+ Kat = H2-Kat H2-Kat + Kat = 2H-Kat N-Kat + H-Kat = NH-Kat + Kat NH-Kat + H-Kat = NH2-Kat + Kat NH2-Kat + H-Kat = NH3-Kat + Kat NH3-Kat = NH3(g) + Kat
Najważniejsze zastosowania amoniaku
-do produkcji nawozów mineralnych
-do produkcji kwasu azotowego, mocznika i sody amoniakalnej
-regulator pH
-czynnik chłodzący w urządzeniach chłodniczych
-ligand w amino kompleksach.
Ze względu na ogólną szkodliwość i drażniący wpływ na błony śluzowe, amoniak został prawie całkowicie wycofywany z przemysłu chemicznego zajmującego się produkcją lakierów, farb i środków czyszczących, które mają bezpośredni kontakt ze skórą i drogami oddechowymi.
Friedrich Bergius
Friedrich Bergius urodził się 11 października 1884 roku w Złotnikach (obecnie dzielnica Wrocławia). Miejskie gimnazjum realne we Wrocławiu ukończył zdając egzamin dojrzałości w 1903 roku. Chemia była jego pasją już od czasów szkoły średniej. Pierwsze praktyki pobierał w laboratorium w fabryce swojego ojca. Przed rozpoczęciem studiów chemicznych na Uniwersytecie we Wrocławiu, odbył półroczną praktykę w zakładach hutniczych w Zagłębiu Ruhry. Pracę doktorską z zakresu chemii nieorganicznej obronił na Uniwersytecie w Lipsku w 1907 roku, gdzie przeniósł się rok wcześniej. Tematem jego dysertacji był problem bezwodnego kwasu siarkowego jako rozpuszczalnika. Jeszcze w tym samym roku objął stanowisko asystenta w Instytucie Chemii Fizycznej na Uniwersytecie w Berlinie. Następnie po dwóch semestrach podjął pracę w Instytucie Chemii Paliw na politechnice w Karlsruhe, gdzie miał okazję współpracować z Fritzem Haberem i brać udział w badaniach związanych z syntezą amoniaku. Od tej pory jego uwaga skupiała się na badaniach syntez w warunkach wysokotemperaturowych i pod wysokim ciśnieniem. W 1910 roku przeniósł się na politechnikę w Hanowerze, gdzie rozpoczął pracę w Instytucie Chemii Fizycznej. Po dwóch latach zrobił tam habilitację. W związku z tym, że na uczelni nie mógł realizować swoich planów badawczych, podjął decyzję o otwarciu własnego laboratorium. Zajął się szerzej zagadnieniem wyodrębniania benzyny z olejów ciężkich oraz uwodornieniem węgla w wysokich temperaturach i pod wysokim ciśnieniem. Pierwsze widoczne sukcesy prac Bergiusa przypadały na rok 1913, kiedy to zgłosił patent na proces uwodorowienia węgla na węglowodory naftopodobne. Aby jego odkrycie mogło zostać przyjęte w realnym procesie przemysłowym, oprócz odpowiednich warunków i aparatury badawczej niezbędne było zastosowanie odpowiedniego katalizatora. Umożliwiłoby to otrzymanie pożądanego produktu odpowiednio szybko i z dobrą wydajnością. W związku z brakiem funduszy na rozwój badań, Friedrich Bergius zdecydował się nawiązać współpracę ze swoim przyjacielem K. Goldschmidtem. Zainwestował w budowę linii technologicznej w Mannheim-Rheinau, gdzie miałby zajmować się uwodorowaniem węgla i osobiście nadzorować proces produkcyjny. Wybuch I wojny światowej przekreślił na kilka lat jego plany. Cztery lata po zakończeniu wojny wznowiono proces produkcji benzyny i związków naftopodobnych. Jednak w dalszym ciągu produkcja benzyny nie była opłacalna z ekonomicznego punktu widzenia. Całe przedsięwzięcie zrujnowało Bergiusa finansowo. Pomimo znalezienia odpowiedniego katalizatora w postaci siarczku molibdenu, był zmuszony sprzedać swoje patenty firmie Badische Anilin- und Soda-Fabrik. BASF udało się rozwinąć produkcję benzyny w zakładach uwodorowania węgla na skalę przemysłową, co okazało się niezwykle korzystne dla Niemiec w czasie II wojny światowej. Oprócz badań związanych z uwodorowaniem węgla Bergius pracował również nad hydrolizą celulozy drzewnej w celu otrzymania glukozy. Jednak w związku z brakiem wystarczających środków finansowych i ograniczeniami technologicznymi, pomimo kilku prób powrotu do badań, zakończyły się one fiaskiem. Osiągnięcia Friedricha Bergiusa dla nauki i przemysłu były jednak tak ważne, że został doceniony i odznaczony Nagrodą Nobla w dziedzinie chemii w 1931 roku. Nagrodę otrzymał wspólnie z Carlem Boschem „za badania wpływu wysokich ciśnień na przebieg reakcji chemicznych”[7].
Metody przeróbki węgla do paliw płynnych
Bergius odkrył i udoskonalił metodę katalitycznego uwodorniania wysokowrzącego oleju, smoły i węgla brunatnego w celu otrzymania benzyny syntetycznej. Proces zachodził w warunkach wysokiego ciśnienia i wysokiej temperatury w obecności katalizatorów, takich jak siarczek wolframu i molibdenu. Wydajność procesu wynosiła 97%. Obecnie wykorzystywane metody upłynniania węgla można podzielić na:
- Metoda bezpośrednia-oparta na metodzie Friedricha Bergiusa
Metoda bezpośrednia polega na zwiększeniu procentowej zawartości wodoru w stosunku do procentowej zawartości pierwiastka węgla w ciekłych węglowodorach, w porównaniu do stałej formy wyjściowej. Udział procentowy wodoru w węglu kamiennym wynosi ok. 5%, a w oleju napędowym i benzynie wynosi on odpowiednio 13% i 16,5%.

- Metoda pośrednia-oparta na metodzie Fischera-Tropscha
Metoda pośrednia polega na zgazowaniu węgla za pomocą tlenu i pary wodnej w wysokiej temperaturze, w wyniku czego otrzymuje się mieszaninę wodoru i tlenku węgla (II), czyli tak zwany gaz syntezowy. Otrzymane produkty gazowe stają się substratami do produkcji węglowodorów.

- Proces hybrydowy zintegrowany
To proces technologiczny stanowiący kombinację obydwu wyżej opisanych metod. Aktualnie jest to najbardziej nowoczesne rozwiązanie w zakresie produkcji paliw płynnych.
Bibliografia
- P. Greiner, „Nobliści z Górnego Śląska”, wyd. „Rzeka”, Wrocław 1999.
- P. Greiner, „Nobliści śląscy”, wyd. „Wokół nas”, Gliwice 1999.
- A. Bielański, Podstawy chemii nieorganicznej, część 2, wyd. naukowe PWN, Warszawa 1994.
- D. Buza, W. Sas, P. Szczeciński, Chemia organiczna, kurs podstawowy, oficyna wydawnicza politechniki warszawskiej, Warszawa 2006.
- F. Fringuelli, A. Taticchi, The Diels-Alder Reaction, Selected Practical Methods, Wiley 2002.
- Z. Sarbak, Reakcje i procesy katalityczne (cz. III), kataliza w przemyśle nieorganicznym; Badania, rok 2015, nr 4 LAB.
- P. Mastalerz, Chemia organiczna, wyd. PWN, Warszawa 1998.
- J. March, March’s advanced organic chemistry, Reactions, mechanisms and structure, Wiley 2007.
- J. Świądrowski, A. Rejman-Burzyńska, E. Jędrysik, Węgiel brunatny jako surowiec do produkcji paliw płynnych, Górnictwo i Geoinżynieria, Rok 31, zeszyt 2, 2007.
Przypisy
- ↑ P. Greiner, „Nobliści z Górnego Śląska”, wyd. „Rzeka”, Wrocław 1999, str. 13-18; P. Greiner, „Nobliści śląscy”, wyd. „Wokół nas”, Gliwice 1999, str. 8-13
- ↑ P. Greiner, „Nobliści z Górnego Śląska”, wyd. „Rzeka”, Wrocław 1999, str. 59-83; P. Greiner, „Nobliści śląscy”, wyd. „Wokół nas”, Gliwice 1999, str. 63-70.
- ↑ P. Greiner, „Nobliści śląscy”, wyd. „Wokół nas”, Gliwice 1999, str. 38-45.
- ↑ Tamże.
- ↑ A. Bielański, Podstawy chemii nieorganicznej, część 2, wyd. naukowe PWN, Warszawa 1994, str. 644-646
- ↑ Tamże.
- ↑ P. Greiner, „Nobliści śląscy”, wyd. „Wokół nas”, Gliwice 1999, str. 46-50
- ↑ J. Świądrowski, A. Rejman-Burzyńska, E. Jędrysik, Węgiel brunatny jako surowiec do produkcji paliw płynnych, Górnictwo i Geoinżynieria, Rok 31, zeszyt 2, 2007, str. 595-596.
.